基因改造,這是個對於一般人來說既神奇又陌生的科技,以我來說就對這種酷酷的東西感到非常興奮😆,大家常聽到的應該都是基因改造食品、解決害蟲氾濫或是會發光的兔子跟浩克等等這種超級生物,沒錯,這些都是可以透過基因編輯的技術來達成的,雖然還沒辦法達到科幻片那樣的程度,因為危險的研究往往都被藏起來了XD,但是他能做到的事也已經發展到讓人驚訝的地步了,這篇就讓我跟大家介紹一下基因編輯有關的簡單知識跟他的發展歷史,以及有如魔法般的CRISPR吧!!👇
老樣子,因為內容有點多,所以可以用下面快捷鍵快速滑到自己有興趣的標題,或是慢慢照順序看下去也可以喔!!🥰🥰
在進入正題前,我們先了解一下關於細菌這個可愛的小東東吧,別看他好像沒甚麼存在感😅,其實他也和我們人體一樣常常對抗病毒的迫害,所以產生了許多有趣的免疫模式,也因為科學家發現細菌的這些特性,使得基因技術可以不斷的進步!!
而細菌中最常見的就是噬菌體(感染細菌的病毒)😈;其構造為一個蛋白質的外套,包裹他的DNA,當外套黏附在細菌表面後,就會將內部的DNA注射到細菌體內,接著噬菌體DNA就會用細菌來當成製造自己外套和DNA的工廠,產出大量的噬菌體,接著再去尋找下一波的犧牲者。(細菌真可悲,根本噬菌體的工具人🤣,用完就被丟掉換其他的了🥲)
當然,細菌也有先天免疫的機制;細菌會製造DNA修飾酶,然後再自己DNA的特定序列上做記號,接著再製造DNA限制酶,去辨識這些特定的DNA序列有沒有標記,如果沒有那就一定是外來的,限制酶就會立刻把他切斷。(就是有點像人臉辨識那樣,如果沒有再設定內的話就打不開手機,只是細菌比較狠一點,他會把人切斷😱)
先天免疫:指病原體尚未進入體內前,系統就已經準備好辨識病原體的大輪廓,並做出防衛動作。
後天免疫:指等特定病源體入侵後,針對該特定病源體的辨識與對抗機制才會啟動。
接下來就是要介紹DNA和RNA這兩個了,想不到只是短短的4個字母之間的排列組合,就能夠築成一個美妙的人體結構,每個人都是獨一無二的存在,但即使我們構造這麼複雜但我卻還是很討厭複雜的東西,看來我很討厭自己😂。
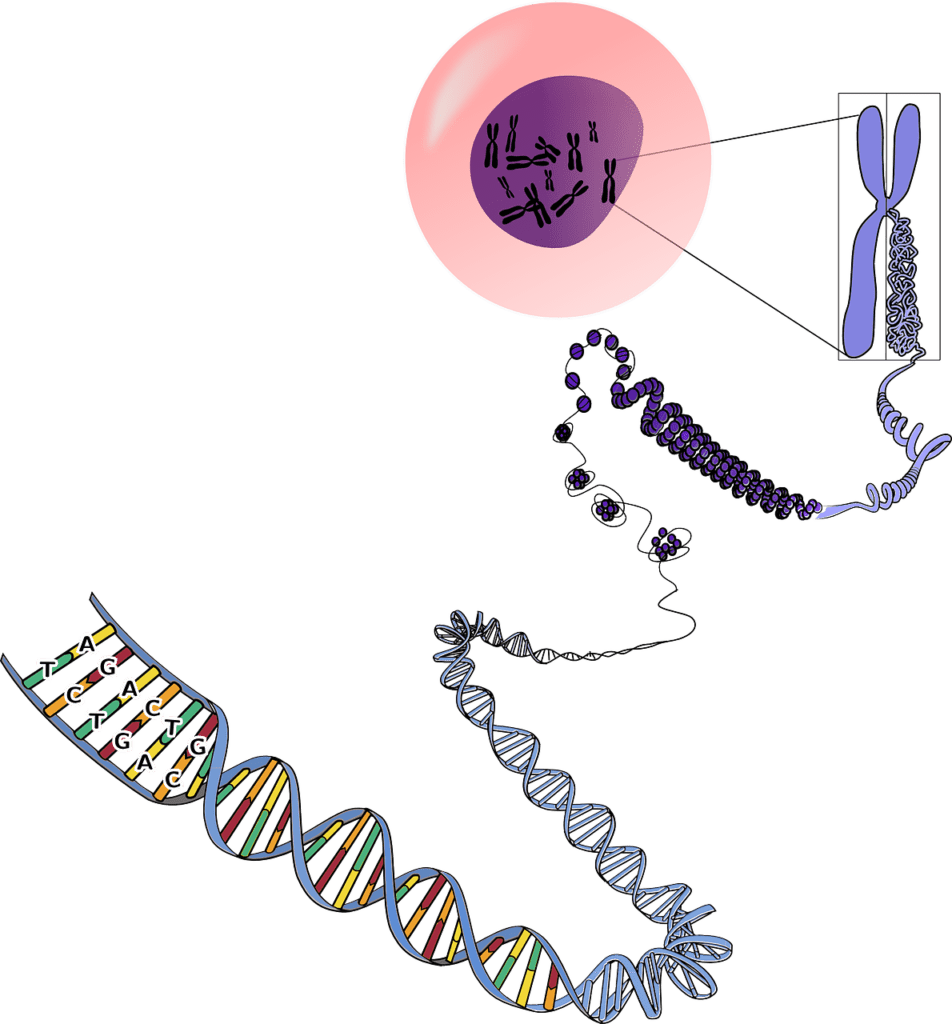
基因體(genome):用來表示基因和染色體的複合用語,為在細胞內部發現的整套遺傳指令(任一個生物體內,絕大多數細胞的基因體都是相同的),他會告訴生物體如何生長和維持生命;我們天生的身體特徵(如視力、身高、膚色、疾病、傾向等等)也是來自基因體中編碼的訊息。(所以如果有喜歡哪種特徵就是去找擁有那些基因的人來結婚就對了XD,)
基因體是由“去氧核醣核酸”(deoxyribonucleic acid,DNA)組成,而DNA僅有四種不同的結構單元,來形成雙螺旋結構。
A腺嘌呤adenine;G鳥糞嘌呤guanine;
C胞嘧啶cytosine;T胸腺嘧啶thymine。 又稱化學基、鹼基。
A必與T配對,G必與C配對,稱鹼基對。
細胞複製前,DNA的兩股會被一個酵素“打開”(解開),再由其他酵素來為每一股打造新的配對股(依照相同的鹼基對規則),這樣就能產生與原始雙螺旋一樣的副本。(就是跟複印紙張很像,掃描後就能夠印出一張一模一樣的紙)
人體基因體包括約32億的DNA鹼基對,約有2100個蛋白質編碼基因;由23條不同片段的染色體成對組成,父母各自提供23條,共46條染色體(正常情況下都為46條)。
“核醣核酸”(ribonucleic acid,RNA),RNA就像工程師(信差)一樣,將資訊、訊息從儲存DNA的細胞核(藍圖、信箱)中,傳遞(轉譯)到細胞核外;轉譯過程中,細胞利用一段段的DNA(遺傳密碼、基因)產生“RNA長鏈分子”來建構一條條的“蛋白質分子”,RNA上每“3”個字母對應一個“胺基酸”(蛋白質的結構單元),而因各基因的核苷酸序列(DNA字母)不同,所以其蛋白質的產物也會不同。
RNA的四個字母中“A”、”G”、”C”與DNA的相同,只有“T”變成“U” (尿嘧啶uracil),且構成RNA骨架的糖分子,也比DNA的糖還多帶了一個氧原子(所以DNA才叫”去氧核醣核酸”)。
DNA複製DNA,DNA轉錄RNA,RNA轉譯蛋白質;分子生物學的中心法則。
在二十三對核染色體或粒線體染色體(完全來自母方)中,任一個突變都有可能導致遺傳疾病;最常見的形式是“取代”(substitution),即一個核苷酸(字母)被另一個替換,造成破壞基因的作用,並產生“有缺陷的蛋白質”。
“鐮形血球貧血症”,是一種“隱性遺傳疾病”,其β球蛋白基因的“第17個”字母A被T取代,因為這個突變導致在轉譯成胺基酸時,將血紅素內原本的麩胺酸變成纈胺酸,而血紅素是紅血球中負責運送氧的主要蛋白質,突變的血紅素分子黏在一起,形成異常的細絲,改變紅血球的形狀,導致貧血以及提高中風和感染的風險,還有造成骨骼異常的疼痛。(這含有8萬多原子的蛋白質,只因”10個”原子的微小變化,就釀成嚴重的後果)
隱性遺傳疾病:他必須要基因的兩個副本都帶有突變才會病發,若只有一個副本突發,那麼另一個正常的基因仍可正常運作,來彌補突變基因造成的負面影響。(僅帶有一個隱性突變副本的人,不會受到很大的影響,但仍然會展現其表徵,並將突變基因遺傳下去)(所以常常說不要近親結婚就是因為這個,會有很大的機率將家族突變基因給顯現出來,造成孩子的基因缺陷😰)
顯性遺傳疾病:代表只要基因中有一個副本帶有突變就足以致病。
透過基因定序分析可以知道個人的罹癌風險、身體行為和特徵等。
病毒的目標就是“劫持”生物細胞,將自己的DNA插入,並誘騙細胞製造出更多病毒;(所以病毒很適合當載體vector,他不僅知道進入細胞和插入DNA的方法,還知道如何讓新的遺傳密碼作用)
反轉錄病毒(Retrovirus):會將自身基因體剪接至細菌染色體中,潛伏並躲過細菌免疫系的偵測,等時機成熟後便發動侵襲大肆感染,因為此特性所以難以根除,因此在人體基因中有約8%(超過2億5千萬個鹼基對),都是由幾千幾百年前感染我們祖先的反轉錄病毒所遺留下來的產物。(根本就是老狐狸阿,一直躲起來想找機會陰人唉😅)
1999年,有一名患者在接受高劑量的病毒載體後,因“產生劇烈免疫反應”而死亡,「基因治療並不是萬靈藥」。
2010年,有5名接受基因治療的嚴重複合型免疫缺乏症SCID(又稱泡泡寶寶)患者,先後罹患了白血病(骨髓癌),主要是反轉錄病毒活化了一個致癌基因,使其細胞不斷增殖。(將數千個DNA字母隨機插入基因體的風險)
病毒載體(基因治療)對於不是由“DNA缺失”或“基因缺陷”所造成的各種傳染病症效果也不佳;例如:如果突變基因所產出蛋白質過於強勢,完全壓制健康基因的產物,則即使插入改良的病毒來傳送健康基因也不會有任何作用。(意思就是一個很壯的人跟一個瘦弱的人打架,即使你一直治療瘦弱的人他也很難打贏很狀的那個人)
“將DNA直接注入細胞”;“將細胞浸泡在DNA和磷酸鈣的混合液中,讓細胞自行吸收DNA”;這些方法能夠將外源DNA合併到自身DNA裡,且一代傳一代,但效率很低。(小老鼠因為很會生😳,成長周期也短,所以常被用做實驗,透過其胚胎發展階段能觀察相應變化)
同源重組(homologous recombination):基因中的副本被剪接到基因體中時,會聚集在一個或幾個區域內,幾百萬個DNA字母進行混合、配對、重組,並不是隨機分布在基因體的染色體上,而細菌就會在同源重組過程中交換遺傳訊息。
染色體碎裂(chromothripsis):為一種現象,當發生時染色體會突然碎裂,接著細胞再進行修復,會導致內部基因大規模重組。(若受損細胞立即遭到修護,則身體影響小,但也有可能在重組過程中,DNA無意間活化了致癌基因)
造血幹細胞:為體內各類血球細胞的原型,具有無窮無盡的增生與自我更新能力😲。
接下來開始講CRISPR被發現前,基因編輯技術的歷史了,每個階段都有不同的方法,且隨著科學家的發現,編輯的技術越來越成熟也比較穩定。
基因編輯,又稱基因靶向、基因操作:利用同源重組的特性來誘騙細胞,讓他們接受”重組DNA”僅是另一條染色體,達到“新的DNA經由同源重組的方式和原本的遺傳密碼結合在一起”;但此做法會發生“非同源重組”或稱“異常重組” (illegitimate recombination),即新的DNA會隨機整合到基因體中,而不是其相配對的序列,這種發生率高達99%,所以代表基因編輯能夠校正突變基因的機率僅有1%。(機率超級低的阿,根本在賭博😅)
雙股斷裂模式(double-strand-break model):兩條染色體中,其中一條因損害而裂開時,會導致DNA雙股斷裂,此時DNA裂開的單鏈末端容易與附近相配的染色體發生融合和交換遺傳訊息。
核酸酶:一種會切斷RNA或DNA(核酸)的酵素。
核酸外切酶:他只會從RNA或DNA鏈的末端切割。
核酸內切酶I-SceI:這種酵素只會從內部切割,有些具有高毒性,不論其序列為何,只要觸碰到了就切割;有些則是具有高度專一性,只會切割某些序列;另外也有許多酵素介於兩者之間;而I-SceI屬於專一性的核酸內切酶,他需要“18個連續的DNA字母完全配對”才會切割。
基因編輯系統三項關鍵條件:
1.能夠辨識特定DNA序列
2.必須能夠切割該序列
3.必須能夠輕易重新編寫
,以便瞄準並切割不同的DNA序列。(而I-SceI只有滿足條件1.2.,不符合條件3.)
鋅指核酸酶(zinc finger nuclease,ZFN):他是將一個能夠切割DNA序列的蛋白質(Foki,細菌核酸酶模組)和一個能夠辨識特定DNA序列的蛋白質(鋅指蛋白,zinc finger protein)來組合成一個嵌合核酸酶。
Foki細菌核酸酶模組:能夠造成DNA長鏈的斷口,但沒有特定的序列偏好。
zinc finger protein鋅指蛋白:以多個重複片段銜接排列而成,每個片段會辨識DNA的三個字母。
但ZFN有很高的比例不會辨識他們應該認識的序列,還有可能鎖定和預設目標不同的序列,害死被指派去編輯的細胞,而且更有當鋅指模組辨識出DNA序列,但核酸酶模組卻沒有加以切割。(這是豬隊友吧…😂)
似轉錄激活因子(transcription activator-like effecter,TALE):他是一個在研究黃單細胞菌時發現的新型蛋白質,他與ZFN非常相似,但TALE有一個最大差別,就是每一個片段只能辨別一個DNA字母(ZFN是3個),所以只要排列這些片段,就能辨識更常DNA序列,只不過不久後“CRISPR”的出現,就直接被取代了。(幫TALE說聲QQ🥺)
噬菌體(bacteriophage):就是會吃細菌的病毒,在1923年時,德赫爾協助蘇聯科學家在提比里西(喬治亞,Tbilisi)成立研究所,每年生產大量的噬菌體來用於臨床治療,直到今日,約還會有20%的細菌感染是用噬菌體治療。(但在1930~1940年,出現抗生素後就開始漸漸沒落)

病毒進入細菌細胞內時,會有兩種途徑來劫持宿主:
1.寄生性,又稱溶原性(lysoqenic):病毒的基因會潛入宿主的基因體中,埋伏一定時間或好幾個世紀,直到正確時機來臨時在大舉進攻。
2.感染性,又稱溶菌性(lytic):這種病毒的基因體會立即搶奪宿主的資源,指示細菌來製造病毒本身的蛋白,而不會製造細菌的蛋白,並複製許多套病毒的基因體,一直到細菌細胞因為壓力而爆開,讓新產生的噬菌體再繼續感染相鄰的細菌。(透過入侵、劫持、複製、增值的循環,病毒在數小時就能消滅整個細菌族群)

接下來才是正題CRISPR,篇幅稍微有點長而且又很乏味,所以請站起來伸展一下身體稍微動一下,讓腦袋的多巴胺分泌一下,不然一定會睡著的😪
CRISPR的RNA分子在細胞內產生的過程:細菌會將整個CRISPR陣列轉換成一長條的RNA長鏈,此長鏈可以跟原本DNA序列上的字母逐字配對(因為RNA是DNA的表親,只差在T變成U而已),製造完RNA長鏈後就會有一種酵素把他們修剪成長度一致的RNA短鏈,這些短鏈之間唯一的不同之處就是間隔序列。(過程中,DNA序列中的一長串重複性陣列轉換成一段段較短的RNA分子,每一條RNA分子都含有特定是菌體的序列)
CRISPR的DNA序列中,會有許多重複序列,每個重複序列間會有間隔序列,間隔序列的差異很大,且與噬菌體基因體的部分序列完全匹配,所以被認為說“間隔序列越多,抵抗噬菌體感染的能力似乎就越強”。
CRISPR-Cas1:他是具有切割DNA的功能,且被認為會協助把新的噬菌體DNA片段插入到新的CRISPR陣列中;
CRISPR-Cas6:他則是專門切割長條的CRISPR RNA分子,使其變成可鎖定噬菌體DNA的短片段。
一開始認為,一旦CRISPR RNA辨認出病毒DNA並與其配對,這些特殊的酵素(Cas)就會攻擊外來的遺傳物質,將其切成碎片,使他們無法發揮效能,而這些假設也獲得許多證實,如CRISPR系統鎖定的噬菌體DNA會在與CRISPR RNA配對時“裂解”;細菌根除內部噬菌體的能力,完全取決於是否具有特定的Cas基因。
Cas基因:他是位於細菌基因體中CRISPR區域的兩側,為似乎有編碼的酵素,這一種特殊類型的蛋白質
對噬菌體遺傳物質發動攻擊,基本上會分成兩階段:
1.CRISPR RNA分子會和十或十一種Cas蛋白質組裝起來(這種組合被稱為Cascade;取自CRISPR-associated complex for antiviral defense意即“抗病毒防禦的CRISPR相關複合體”)它的作用為確定出需要摧毀的病毒DNA確切序列,就像是定位系統一樣。
2.Cascade會定位並標記相對應的病毒DNA序列,在派出一個叫Cas3的酵素蛋白(核酸酶),去將標記的DNA切斷。
執行DNA切割的關鍵組成:Cas9酵素、CRISPR RNA和TracrRNA。
使用“放射性磷”和“凝膠電泳”可以觀察DNA是否為Cas9所切割,放射性磷原子會附在DNA分子的末端,可使X光底片曝光;而凝膠電泳就是使用高電壓迫使DNA片段穿過一塊果凍狀的大凝膠,其功能就像分子篩,會把大小不同的分子分開來;將凝膠暴露在X光底片下,一旦DNA為Cas9切割,就會展現出多個區域或條帶,一條是全長的DNA,另一條則是切成兩段的DNA。(一段具有50個字母的DNA雙螺旋只有17奈米長,即10億分之17公尺,約為1根頭髮直徑的千分之一)
或是使用綠色螢光蛋白(簡稱GFP,為水母基因)來增加辨識度。
(別擔心我在這邊陪你繼續讀下去,加油💪!!)
CRISPR相關公司發展歷史:
2013年11月,丘奇(George Church)、楊格(Keith Joung)、張鋒(Feng Zhang)、劉如兼(David Lin)、珍妮佛•道納(Jennifer A. Doudna)成立了艾迪塔斯醫藥公司(Editas Medicine)
2014年5月,夏彭提取成立CRISPR醫藥公司(CRISPR Therapeutics)
2014年11月,因特利亞醫療公司(Intella Therapeutics)
基因只是訊息的載體,就像房子的藍圖一樣;而基因編輯的目的不僅要改變藍圖,還要改變整個建築的結構形式;即要改變基因編碼的蛋白質。
基因表現:首先,細胞核中會製造出傳訊核醣核酸(messenger RNA,mRNA),他是一個單股的一串字母組成,可以和與他抄寫的DNA序列相匹配(T為U取代)接著,mRNA會送到細胞核外的核糖體(蛋白質的合成工廠),將RNA的四個字母(A、G、C、U)轉譯為構成蛋白質語言中的20個小字母(20個胺基酸)。
轉譯:是按照遺傳密碼來進行的,每3個RNA字母組成一個密碼子,透過密碼子來指示核糖體加上一個特定的氨基酸(而密碼子有64-“43“種可能,但胺基酸只有20種,即20個空位只有64種可能性,所以有許多密碼子編碼是相同的胺基酸);另外有3個密碼子是終止蛋白質合成的訊號。
核糖體會從mRNA的一端開始,必須精確地接連讀取一個個密碼子,將相應的氨基酸添加到這條不斷增長的蛋白質鏈上,直到他到達mRNA的另一端;一旦讀取錯位或偏移,將會產生亂七八糟的蛋白質,且如果亂碼中含有3個終止碼的任一個,將造成轉譯過程提前終止,打亂基因的表現。
而CRISPR的最基本能力就是“破壞基因產生功能性蛋白質的能力”,若因CRISPR編輯後發生小幅度插入或缺失的話,大部分情況都會破壞遺傳密碼的三字母型態,造成“蛋白質突變”或“基因剔除”。(應該還沒睡著吧XD)
基因剔除(gene knockout):關閉了基因的功能,使蛋白質不能發揮正常的作用。
在2014年,德州大學的研究團隊透過CRISPR來使“TYR基因”突變,最後有約11%的小老鼠完全白化,而一年之後,日本團隊的研究成功率達到97%,此動作永久改變一整代的遺傳組成。
TYR會製造一種稱為駱胺酸脢(tyrosinase)的蛋白質,與黑色素的合成有關,如果突變的話會造成“白化症”。
一般來說,在染色體斷開的情況時,細胞會把末端隨便連接起來,但若是有一條與斷開後兩末端相對應的DNA時,細胞會使用他來讓細胞兩末端序列完美重疊,將其黏貼到染色體的斷裂處。(同源重組和同源修復homology-directed repair)
利用CRISPR來切割一個染色體上兩個相鄰的基因時,細胞會用三種方式的其中之一來重新組裝染色體,使其能夠繼續活下去;
1.全速進行受損末端的連接修復,但由於細胞分子會不斷任意移動,因此採行這種修復模式的機率非常低。
2.若兩切點之間的DNA片段漂走了,細胞就會乾脆不理會遭切除的片段,直接將兩頭末端黏合起來。
3.有一種情況是切割出來的DNA片段仍擠在附近,且大致維持在原處只是翻轉過來,原本的頭尾位置會對調,此時促使末端連接修復的同一種酵素就會不管那段DNA的方向直接重新連回去。
去活化的Cas9:以遺傳工程改變胺基酸後,可得到不在能切割DNA,但可以在基因體中搜尋特定DNA並定位,這種去活化的CRISPR再也不能編輯DNA來引入永久的遺傳變化,但卻能影響遺傳訊息的表現方式,就像一個“基因表現控制器”,可以打開、關閉基因,或是增加、減少基因的表現;(去活化CRISPR系統就向一輛分子貨車,科學家將蛋白質(貨物)與Cas9或響導RNA結合起來,然後CRISPR在運送這些蛋白質到細胞中的特定基因處,來影響基因表現出來的功能)
基因驅動(gene drive):一般情況下,帶有兩套染色體在進行正常有性生殖時,子代會從親代雙方各獲得染色體的一個副本,代表任意基因的變異型都有50%的可能性都會傳下去,但有些“自私基因”的DNA序列,會增加他們在每一代基因體的頻率,即使他們沒有為後代提供適應上的優勢;而基因驅動的想法是以基因剃除為基礎,利用CRISPR在特定位置切割DNA,並插入一個部分包含CRISPR本身的遺傳資訊DNA序列,而這個基因會自動將自己複製到新的染色體中,使得他在整個族群中出現指數型的快速增長(有點像木馬病毒那樣,會一直不斷的複製自己)。
基因可以編輯“體細胞”(除了生殖細胞以外的其他細胞,如心臟、肌肉、腦、皮膚、肝臟細胞等等,其不能將DNA傳給後代)或是“生殖細胞”(會將遺傳物質從一代流傳到下一代,如精子、卵子或人類胚胎發育早期的幹細胞);但通常會編輯生殖細胞,因為若有一個受精卵中的錯誤,當成熟長大複製到數十億後代細胞中,幾乎就不能消除疾病留下的所有痕跡(例如,報紙印好發送出去後,試圖糾正新聞報導中的錯誤,和文章還在以文字檔案存在編輯的電腦中時修正錯誤,這兩者之間所要付出的努力有多大的差別)(這也代表現在看這篇的人如果想要編輯自己會比較困難一點,包括我😭,看來只能將希望寄託在未來自己的小孩身上了)

Addgene:一個非營利的組織,專門在製造、販賣CRISPR的人工基本染色體(質體)。
去滅絕(de-extinction):透過選殖技術或基因工程讓已滅絕的物種死而復生。
基改生物(genetically modified organism,GMO)與基因編輯生物;
前者為:含有隨機插入基因體的“外源基因”,這些基因會產生新的蛋白質,並賦予這種生物先前不具備的有益特性。
後者為:對生物體“現有的基因體”進行微小改變,調整現有的蛋白質濃度,從而賦予生物體有益的表徵,並且沒有添加任何外源DNA。
肌肉生長抑制基因(myostatin gene):他的功能就像肌肉組織的自然剎車一樣,只要有突變或是缺陷的情況時,都會產生強壯的體態和較重的體重,且脂肪並沒有增加。
Revivicor公司:一家在開發一種移植的公司(人體器官培養)。
腺相關病毒(adeno-assaciated virus,AAV):是一種對人類無害的病毒,只會引起輕微的免疫反應,為特別重要的“載體”。(現在有些人類用疫苗也是透過這種方式來獲得對病毒的免疫力)
載體:就是病毒被關閉剪接功能和消除毒性,並被用來載送遺傳資訊的東西,其可以容易的加裝有Cas9蛋白的編碼及嚮導RNA的治療用基因,傳送到宿主細胞的效率也很高。
脂質奈米顆粒來當載體:目前正在研究這個,此載體不會分解且容易製造,還具有將Cas9蛋白質及響導RNA依照設定方式釋放到患者體內的優點。
體外人工授精(in vitro fertilzation,IVF):讓純化的卵子和精子在培養皿中混合,將受精卵培養成多細胞胚胎後,在植入子宮內。
桃莉羊(1996年誕生):將取自成年綿羊體細胞的細胞核及全部DNA轉移到除去細胞核的卵細胞中,接著刺激此雜合細胞分裂,再將產生的胚胎植入代理孕母的母羊體中,最後就會製造出一隻基因體和細胞供體完全一樣的複製母羊。
胚胎著床前基因診斷(preimplantation genetic diagnosis ,PGD):代表醫師在實施體外人工授精時,可以再將胚胎植入母體前,先分析候選胚胎的DNA,來確保所選擇的是最健康的基因體。
CRISPR可以實現農業、牧業、瘧疾、人體器官培養、客製化動物外型等等的改變;慢慢成熟不易爛掉的番前、應付氣候變遷的植物、無法傳遞瘧疾的蚊子、肌肉強化的警用訓練狗、人體器官移植的基因工程豬、長毛猛瑪象再現。

“CRISPR還是難避免脫靶效應,這是需要解決的問題”
但是可以被預測機率,只會發生在基因當中20個字母序列與其差異1個字母的序列,所以可以用電腦演算法來自動探測人體基因中30億對字母有多少相似的序列,來避免潛在的風險,但不見得每次都能預測到脫靶編輯,所以可以先在實驗室中培養細胞,來測試一堆相關DNA序列,看誰的脫靶效應最低在開始臨床實驗,或是透過一些基因工程來使CRISPR必須識別的DNA變長,增加其辨識標靶DNA的能力,來減少錯誤配對的機會,最後劑量越多也會影響分子待在細胞內的時間,太多的話就待得越久,愈有可能去找那些序列相似但不完全相配的區段來進行脫靶編輯。
“軟骨發育不完全正(侏儒症) “、慣性肉芽腫痛、阿茲海默症、先天性聽力損失、肌萎縮性脊隨側索硬化痛、高膽固醇、糖尿病、戴-薩克斯症、皮膚病、X染四體脆折症、不孕症,幾乎所有特定突變或是DNA序列缺陷有關的病症都能用CRISPR來逆轉或取代。
但若是由“遺傳變異”和“環境等複雜因素”組合在一起引發的(如自閉症到心臟病等等”非顯著的遺傳因果關係”),基因編輯的用途可能會顯得更有限。

基因編輯可以使人們獲得很多好處,包括解決各種遺傳疾病及身體缺陷問題和環境控制與農作物改良等等,只是如果遭到不當使用可能會產生反效果,人體基因產生突變或是影響到生態系與人類的生活模式等等

(

(

本篇參考-珍妮佛•道納;山繆爾•史騰伯格 著作•CRISPR-Cas9

